ach der Eröffnung des 26. Urologischen Winterworkshop durch Prof. Dr. Martin Kriegmair startete die DGFIT ihr schon traditionelles Satellitensymposium. Im Kongresszentrum des Hotels Krallerhof, eingerahmt in eine wunderschöne Winterlandschaft, wurde eine Reihe von hochinteressanten Vorträgen von renommierten Experten gehalten. Das Symposium fand unter der Leitung von Prof. Dr. Michael Siebels (München) und Prof. Dr. Dominik Rüttinger (Penzberg) statt. Am Ende des Symposiums wurde zusätzlich der dotierte wissenschaftliche „Clinical Science Award“ der DGFIT an die Arbeitsgruppe um Prof. Dr. Elfriede Nössner (Helmholtz Zentrum München, Immunoanalytics- Core Facility & Research Group Tissue Control of Immunocytes) für Ihre Arbeit mit dem Titel „Progressive natural killer cell dysfunction associated with alterations in subset proportions and receptor expression in soft-tissue sarcomapatients“ verliehen.
Die Vorträge des DGFIT-Symposiums werden im Folgenden kurz dargestellt:
Prof. Dr. M. Siebels: Immun-Checkpoint Inhibitoren beim Nierenzellkarzinom
In der Behandlung von Patienten mit fortgeschrittenem Nierenzellkarzinom (RCC) ist die „targeted therapy“, mit der sich die Signaltransduktion zum Beispiel durch Tyrosinkinase(TKI)- oder mTOR-Inhibitoren auf mehreren Ebenen blockieren lässt, inzwischen fest im klinischen Alltag etabliert. Doch trotz aller Fortschritte in der Therapie ist die Prognose der Erkrankung weiterhin schlecht und komplette Remissionen sind selten.
Ein neuer Angriffspunkt in der RCC-Therapie könnten sog. Immun-Checkpoint-Rezeptoren PD (Programmed Death)-1 sein. In der zulassungsrelevanten, randomisierten offenen Phase-III-Studie CheckMate-025 der PD1-Inhibitor gegen Everolimus getestet. Erstmalig wurde das OS beim vorbehandelten Patienten mit fortgeschrittenem RCC zum primären Studienendpunkt gewählt. Insgesamt waren 821 Patienten mit fortgeschrittenem klarzelligen RCC eingeschlossen; 72 % der Patienten waren mit einer und 28 % mit maximal zwei antiangiogenetischen Therapien vorbehandelt. Die Randomisierung der Patienten erfolgte entweder auf Nivolumab (Opdivo®) 3 mg/kg intravenös über 60 Minuten alle zwei Wochen oder Everolimus 10 mg täglich oral. Im Ergebnis erreichten Nivolumab-behandelte Patienten ein medianes OS von 25,0 Monaten versus 19,6 Monaten unter der Vergleichstherapie mit dem mTOR-Inhibitor. Damit konnte das Sterberisiko im Nivolumab-Arm (n = 410) gegenüber Everolimus (n = 411) um 27 % reduziert werden (HR 0,73; p = 0,002). Der mediane Überlebensvorteil konnte in allen Subgruppen und wurde unabhängig vom PD-L1-Status (Tumormembran-Expressionsgrad von < 1 % oder ≥ 1 %) nachgewiesen. Mit 25 % versus 5 % im Vergleichsarm sprachen Patienten unter Nivolumab signifikant häufiger an (objektives Ansprechen, p < 0,001). Die Studie wurde im Juli 2015 vorzeitig beendet, weil die Überlegenheit von Nivolumab hinsichtlich des OS frühzeitig erreicht wurde.
In einem aktuellen update der Studie, präsentiert von Plimack et al. auf dem 15th International Kidney Cancer Symposium 4.-5.Nov.2016 in Miami, konnte eine weitere Verbesserung des OS um 6,3 Monate gezeigt werden. (Abb.1)
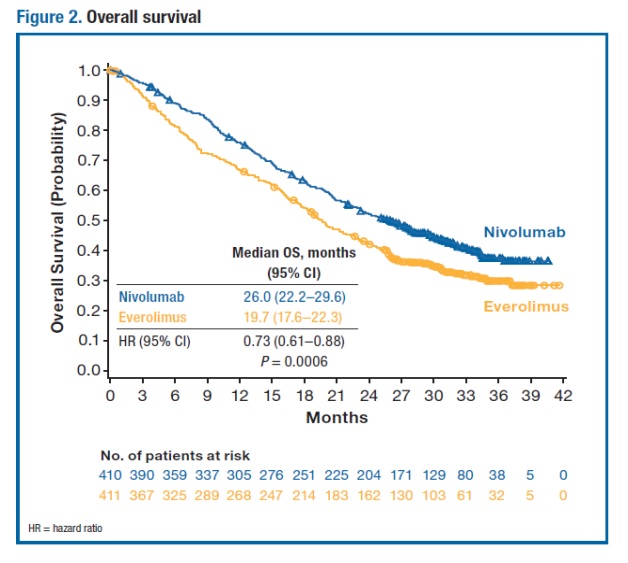
Verglichen mit dem mTor-Inhibitor war die Behandlung mit Nivolumab seltener mit therapiebedürftigen Nebenwirkungen assoziiert. Unter Nivolumab traten Nebenwirkungen Grad 3 oder 4 bei 19 % der Patienten auf, gegenüber 37 % unter dem mTOR-Inhibitor. Dies könnte ein Grund dafür sein, dass die LQ, welche anhand von FKSI-DRS Fragebögen gemessen wurde im Nivolumab-Arm über die Therapie Zeit im Vergleich zu Everolimus deutlich anstieg.
Aktuell sind fast 50 Studien! mit dem Wirkstoff Nivolumab registriert: Einige interessante Beispiele sind „Nivolumab in Treating Patients With High-Risk Non-Metastatic Kidney Cancer“, „Nivolumab and Stereotactic Ablative Radiation Therapy (SAbR) for Metastatic Clear Cell Renal Cell Carcinoma“, „Study CB-839 in Combination With Nivolumab in Patients With ccRCC and Other Solid Tumors“ und „Study of Nivolumab Plus Chemotherapy in Patients With Advanced Cancer (NivoPlus)“.
Ein weiterer sehr interessanter PD-L1 Antikörper ist Atezolizumab (Tecentriq®) der Firma Roche, welcher von der FDA in den USA bereits für das Bronchialkarzinom zugelassen wurde. Erste Phase 1 Daten beim RCC zeigen gute Ansprechraten bei geringer Toxizität, in etwa vergleichbar mit Nivolumab. Eine vor kurzem publizierte Arbeit in Nature zeigte eine Verbesserung der T-Zell Migration beim mRCC durch die Kombination von Atezolizumab und Bevacizumab. In der derzeit laufenden Studie Immotion-150 wird diese Kombination gegen Atezolizumab allein und Sunitinib getestet.
Die guten Ergebnisse der Checkpoint-Immuntherapien beim RCC stimmen optimistisch. Es bleiben aber noch viele Fragen unbeantwortet: Welchen checkpoint-Inhibitoren sollten/können kombiniert werden, was bewirken checkpoint-Inhibitoren in Kombination mit VEGF TT oder Chemotherapien, wie sieht die optimale Sequenz aus und die wichtigste Frage, welche Pat. sind für die Therapien geeignet oder sprechen am besten an, gibt es dafür Biomarker?
Michael Rink: Die S3 Leitlinie Blasenkarzinom: Welche Bedeutung hat die Immuntherapie?
Das Urothelkarzinom der Harnblase besitzt eine ausgesprochen große genetische Heterogenität. Epitope durch Zufallsmutationen in den Tumorzellen spielen eine signifikante Rolle in der Immunogenität eines Tumors und bei der adaptiven Immunantwort. Aufgrund seiner hohen Mutationsfrequenz ist das Urothelkarzinom ein immunogenes Karzinom. Der Einsatz der Immuntherapie ist daher beim Urothelkarzinom nicht völlig neu. Seit Mitte der 1970 Jahre stellt eine intravesikale Immuntherapie mit Bacillus Calmette Guerin (BCG) eine feste Standardtherapie in der adjuvanten Behandlung des Nicht-Muskelinvasiven Blasenkarzinoms dar. Die neue S3-Leitline zum Blasenkarzinom positioniert sich recht klar in der Empfehlung bezüglich des Einsatzes von BCG: Wenn bei Patienten mit einem Urothelkarzinom der Harnblase im high-risk Stadium keine Früh-Zystektomie indiziert ist, soll eine BCG-Instillationstherapie vorgenommen werden. Bei kompletter Remission nach der Induktionsphase (6 Instillationen in wöchentlichen Abständen) soll zusätzlich eine Erhaltungstherapie erfolgen. Die Erhaltungstherapie soll mit jeweils 3 BCG-Instillationen in wöchentlichen Abständen nach 3, 6 und 12 Monate nach Beginn des Induktionszyklus durchgeführt werden und bei high-risk Tumoren bis zu 36 Monate fortgeführt werden. Rationale hierfür ist die Tatsache, dass eine BCG-Therapie Erhaltungstherapie bei intermediate und high-risk Tumoren die Rezidivrate signifikant gegenüber einer Chemotherapieinstillation reduziert, während dieser Effekt bei einer alleinigen Induktionstherapie nicht sicher nachweislich ist. Ein Einfluss auf die Progressionsrate ist nicht gesichert. Ein Unterschied zwischen den verfügbaren BCG-Stämmen in Bezug auf Wirksamkeit und Nebenwirkungsrate ist derzeit nicht belegt. Der Einfluss von Maßnahmen zur Reduktion von Nebenwirkungen bei einer BCG-Instillationstherapie (z.B. Dosismodifikationen, begleitende Antibiotikagabe) auf die Rezidiv- und Progressionsrate ist insgesamt unzureichend untersucht.
Neuere Daten belegen zudem eine Wirksamkeit intravenös applizierter Immuntherapeutika (PD-1/PD-L1 Rezeptor Inhibitoren) in der Behandlung des fortgeschrittenen und metastasierten Urothelkarzinoms. Da die Studiendaten allerdings bislang fast ausschließlich auf Phase I/II Daten beruhen, wird in der S3 Leitlinie zurecht konstatiert, dass die Ergebnisse aktuell laufender Studien abgewartet werden müssen, wie eine PD-1 bzw. PD-L1 gerichtete Immuntherapie in der Zweitlinien Therapie bzgl. Wirksamkeit und Verträglichkeit gegenüber den konventionellen Chemotherapeutika einzuordnen ist.
Zusammenfassend hat die Immuntherapie bereits einen festen Stellenwert in der Therapie des lokalisierten Urothelkarzinoms und wird evtl. auch bald in der Therapie der fortgeschrittenen Tumore Einzug nehmen.
Gerson Lüdecke: Nierenzellkarzinom transparent – Vorstellung der neuen RCC-App
Der Titel ist Programm. Zielsetzung unserer Entwicklungsarbeit, die in Zusammenarbeit eines 32-köpfigen Expertengremiums und der Firma Novartis entstanden ist, ist es die Therapie des Nierenzellkarzinoms von der Primärdiagnose bis zur Nachsorge strukturiert und Evidenz-basiert im neuen Format einer App jedem interessierten Mediziner zur Verfügung zu stellen. Hierbei ist es in der heutigen Zeit so, dass sowohl Web-basiert als auch Device-basiert im klinischen Alltag gearbeitet wird. Durch die Anwendung einer HTML 5 Programmierung ist es gelungen, ein unterstützendes Werkzeug für den klinischen Alltag sowohl für die Kitteltasche als auch für das Arztgespräch am Schreibtisch in der ärztlichen Praxis zu generieren. Zu jedem Zeitpunkt, der im Rahmen eines Patientenkontaktes und der aufkommenden Differenzialdiagnose Nierenzellkarzinom entsteht, bietet diese App die notwendigen Antworten zum nächsten Schritt in der therapeutischen Betreuung.
Hierzu wurden die Kausalketten für Diagnostik, operative Therapie, pharmakologisch, palliative Therapie von der First Line bis zur Last Line Behandlung, begleitende supportive Therapien und der Nachsorge abgebildet. Im Bereich der Pharmakotherapie wird sowohl die Frage der evidenzbasierten Sequenz als auch alle pharmakologisch relevanten Interaktionsfragen, das Nebenwirkungsmanagement und die Schweregrad assoziierte Therapiesteuerung transparent dargestellt.
Ferner bietet die Software die Möglichkeit, dass alle Kolleginnen und Kollegen, die sich in der medizinischen Ausbildung zum Urologen oder Onkologen befinden mithilfe dieser App eine Lernsoftware an die Hand bekommen, die jederzeit die Fakten beschreibt und daraus resultierend die Fragestellungen klar formuliert. Über die integrierte Verlinkungstechnologie, die eine besondere Leistungsstärke dieser Software darstellt, ergibt sich für jeden Nutzer, dass er im Rahmen der Übung an die jeweils richtige Stelle in der Software geführt wird, um die Antworten auf die gestellten Fragen zu erhalten. Durch die ebenfalls integrierte Rücksprungtechnik, realisiert über Verlinkung findet der Nutzer unmittelbar zurück in den Fall, an der Stelle, wo er die Fragestellung verlassen hat. Auf diese Weise kann das Krankheitsbild in komplettem Umfang in einer interaktiven Weise mit kurzfristiger Lernkontrolle abwechslungsreich abgearbeitet werden. Lernen wird nicht langweilig. Antworten führen zu neuen Fragen. Die App führt zu neuen Antworten.
Dieses Grundsatzprinzip ist in dieser Softwareentwicklung für das Krankheitsbild Nierenzellkarzinom an jeder Stelle verwirklicht. Da das Krankheitsbild im Moment und absehbar auf die Zukunft eine ständig sich weiter entwickelnde medizinische Herausforderung darstellt, kann die App sicherstellen, dass in einem Zeitversatz von etwa acht Wochen neueste Entwicklungen in die Software integriert werden und damit dem Nutzer unmittelbar über einen integrierten Update-Mechanismus zur Verfügung stehen.
Diese softwarebasierte Technologie ist einer klassischen Buch Abhandlung eines Krankheitsbildes maximal überlegen. Flexibilität, Aktualität, Variabilität und Evidenz sind hierdurch ständig abgebildet. Zu finden ist dieses medizinische Tool, welches kein Medizinprodukt darstellt, unter der Internetadresse www.nierenzellkarzinom.info und im iTunes App Store und im Google Play Store unter den Suchbegriffen Nierenzellkarzinom transparent.
Clinical Science Award 2016
Der Clinical Science Award der DGFIT wurde für das Jahr 2016 an Elfriede Nößner und Ihre Arbeitsgruppe vom Helmholtz Zentrum München für Ihre Arbeit „“Progressive natural killer cell dysfunction associated with alterations in subset proportions and receptor expression in soft-tissue sarcomapatients“ auf dem DGFIT Satellitensymposium des „Urologischen Winterworkshop“ im Januar 2017 in Leogang verliehen.
Auch in diesem Jahr kam der unabhängigen Jury eine schwere Aufgabe zu aus den wissenschaftlich exzellenten eingereichten Arbeiten die „Richtige“ auszuwählen.
Die prämierte Arbeit wird nun im Folgenden vorgestellt.
Krebs-Immuntherapie, Checkpoint Inhibitoren, und zukünftige Therapiekombinationen
Elfriede Nößner, Helmholtz Zentrum München, Immunanalytik AG Tissue Control of Immunocytes und Core Facility, Marchioninistraße 25, 81377 München; noessner@helmholtz-muenchen.de
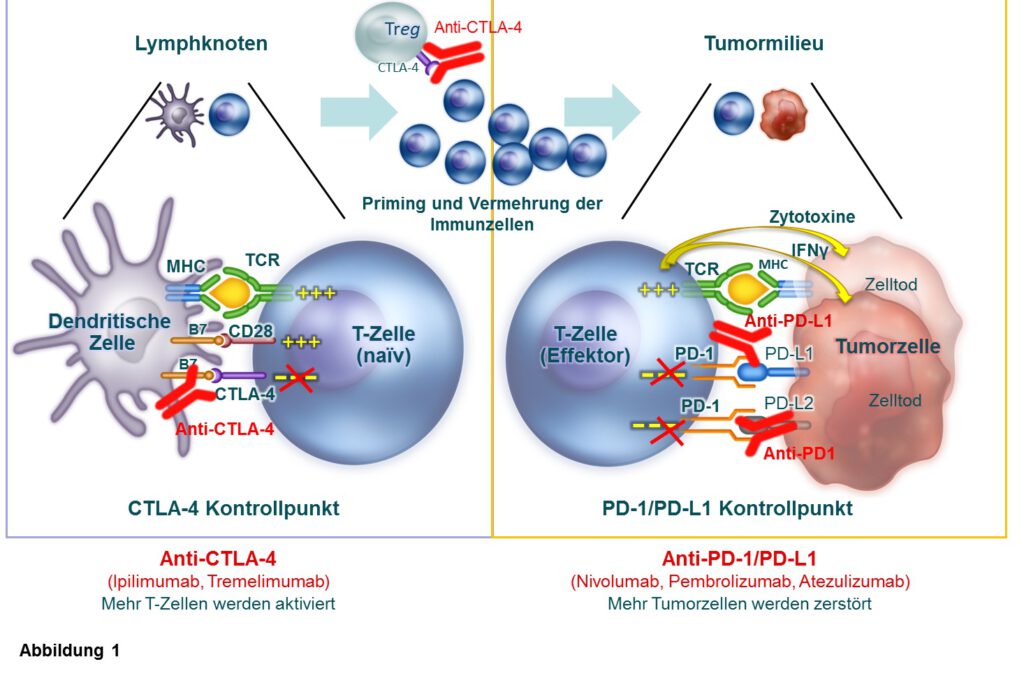
Nach Jahren der Skepsis hat sich nun die Immuntherapie neben Chirurgie, Chemo- und Strahlentherapie und molekular-zielgerichteter Therapie als 5. Säule der Krebstherapie etabliert. Dies begründet sich in den Resultaten mehrerer klinischer Studien, die in randomisierten Ansätzen dauerhafte Remissionen bei Patienten mit metastasierten Tumoren dokumentieren, bemerkenswerte Ergebnisse bei Patienten in Tumorprogress nachdem alle verfügbaren Therapiemaßnahmen ausgeschöpft waren. Insbesondere der Einsatz sogenannter Checkpoint-Inhibitoren,das sind Antikörper die gegen Immunkontrollpunkte (CTLA-4, PD-1/PD-L1) gerichtet sind und die T-Zellen dazu anregen ihre Arbeit wieder aufzunehmen, ist zukunftsweisend (Abbildung 1). Die Checkpoint-Inhibitoren zeigen das Potenzial, die Prognose der Patienten entscheidend zu verbessern und stellen sogar eine langfristige Tumorkontrolle in Aussicht, selbst bei Patienten mit metastasierten Nierenzellkarzinom, dem Bronchialkarzinom, und dem fortgeschrittenen Urothelkarzinom, einer Indikation, in der seit gut 30 Jahren kein wesentlicher therapeutischer Fortschritt erzielt wurde. Trotz dieser bemerkenswerten Behandlungserfolge besteht weiterhin Bedarf an neuen Therapiestrategien, denn deutliche klinische Erfolge werden nur bei Subgruppen von Patienten erreicht.
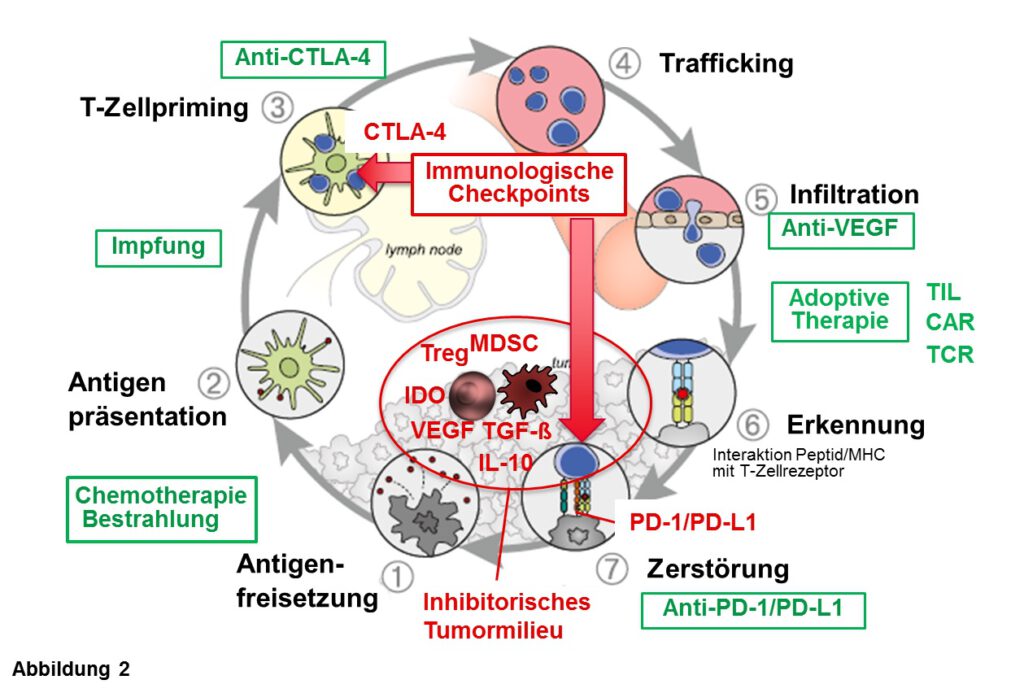
Blickt man in die Prozesse, die zur erfolgreichen Aktivierung einer Immunantwort nötig sind, so kann man verschiedenste potentielle Ursachen erkennen, wie ein Tumor dem Immunsystem entkommen kann. Gleichzeitig ergeben sich vielfältige Möglichkeiten, um das Spektrum an Immuntherapien zu erweitern (Abb. 2). So nutzen Tumorzellen nicht nur die immunologischen Checkpoints (CTLA-4, PD-1/PD-L1), um sich vor dem Angriff durch das Immunsystem zu schützen, sondern sie umgeben sich auch mit verschiedensten inhibitorischen Zellen (regulatorische T-Zellen oder Makrophagen), Stoffwechselmediatoren (IDO, Azidose) und Zytokinen (IL-10, TGF-ß), welche die Aktivität tumorzerstörender T-Zellen inhibieren. Darüber hinaus sind oftmals die Blutgefäße, die den Tumor versorgen, verändert, so dass die Immunzellen nicht in den Tumor eindringen können. In solchen Fällen sind therapeutische Kombinationsansätze vielversprechend, die zusätzlich zur Checkpoint-Inhibition Therapeutika einsetzen, die das Gefäßsystem normalisieren und das schädliche Tumormilieu verbessern. Auch die Kombination der beiden Checkpoint-Inhibitoren (anti-CTLA4 und anti-PD-1/PD-L1) ist sinnvoll, weil beide an verschiedenen Schaltstellen der Immunregulation eingreifen. Durch Blockade von CTLA-4 sollten mehr T-Zellen zu Kampf gegen den Krebs aktiviert werden, und diese sollten nach Infiltration in das Tumormilieu durch Blockade des PD-1/PD-L1 Checkpoints mehr Tumorzellen zerstören können (Abb. 1, 2). Verschiedene Kombinationen werden bereits in klinischen Studien getestet und zeigen vielversprechende erste Ergebnisse mit erhöhtem Ansprechen in Kombitionsansätzen.