DGFIT auf dem 28. Urologischen Winterworkshop in Leogang/Österreich
Die Veranstaltung eines Satellitensymposiums durch die DGFIT im Rahmen des alljährlichen Urologischen Winterworkshops in Leogang/Österreich hat schon lange Tradition. Auch in diesem Jahr präsentierten hochkarätige Referenten/innen therapeutische und diagnostische Innovationen mit besonderem Fokus auf das Thema der checkpoint-Inhibition beim Nierenzell- und Urothelkarzinom. Das Symposium fand unter der Leitung von Prof. Dr. Axel Hegele, Marburg und Prof. Dr. Michael Siebels, München.
Am Ende der Veranstaltung wurde der jährlich vergebene Wissenschaftspreis der DGFIT an Dr. Marie-Nicole Theodoraki, Ulm (1. Platz),
PD Dr. Philipp Wolf, Freiburg, (2. Platz) und in Abwesenheit an Dr. Johannes Breyer, Regensburg, (auch 2. Platz) verliehen.
Weitere Informationen Urologischer Winterworkshop
Zusammenfassung Vorträge:
Prof. Dr. Hans Heinzer, Hamburg Prostatakarzinom 2019: Die Immuntherapie ist tot, lang lebe die Immuntherapie!

In den letzten Jahren sorgte das Konzept der Immuntherapie gerade beim metastasierten, kastrationsresistenten Prostatakarzinom für viel Furore. Insbesondere die autologe Immunzelltherapie mit Sipuleucel-T konnte konnte in einer Phase III-Studie (IMPACT) überzeugen. Das Gesamtüberleben konnte gegenüber Placebo signifikant um 4.1 Monate verlängert werden. Diese positiven Daten führten dann zur Zulassung der Substanz durch die FDA und EMA. Nach Markteinführung in den USA war noch 2014 geplant, mit einer weiteren Studie Sipuleucel-T auf dem Europäischen Markt einzuführen. Überraschenderweise wurde dann 2015 die Zulassung in Europa zurückgezogen und sämtliche Pläne zur Markteinführung von Sipuleucel-T in Europa aufgegeben.
Eine weitere vielversprechende Immuntherapie beim Prostatakarzinom zeichnete sich ebenfalls in den letzten Jahren mit der Vakzine PROSTVAC-VF ab.Auch hier konnte zumindest in einer Phase II-Studie ein signifikanter Überlebensvorteil gezeigt werden und aufgrund der positiven Ergebnisse eine Phase III-Studie angeschlossen werden (PROSPECT). Im September 2017 musste dann der Sponsor dann verkünden, dass die Studie aufgrund enttäuschender Ergebnisse in einer ersten Interimsanalyse gestoppt werden muss. Eine mögliche weitere Studie als Kombinationstherapie wurde bis heute nicht initiiert.
Nach der zwischenzeitlichen Verfolgung anderer Therapiekonzepte beim metastasierten, kastrationsresistenten Prostatakarzinom nimmt die Immuntherapie langsam wieder Einzug beim Prostatakarzinom. An zentraler Stelle stehen zurzeit dabei die Checkpoint-Inhibitoren. Mit Pembrolizumab sind auch schon die ersten Studien auf den Weg gebracht. KEYNOTE-199 untersucht dabei den Benefit bei Patienten nach Docetaxel-Therapie auch abhängig vom PD-L1-Status. Erste ermutigende Ergebnisse konnten auf dem ASCO 2018 gezeigt werden.
Interessante Ansätze zeigen auch neue Medikamente zum DNA Damage Repair wie Olaparid oder Rucaparib. Auch wenn diese nicht der klassischen Immuntherapie zuzuordnen sind, können sie eventuell in der Kombinationstherapie eine interessante Rolle spielen.
Zusammenfassend wird es sich zeigen, ob neue Medikamente die Immuntherapie beim Prostatakarzinom langfristig beeinflussen können.
Dr. Marie-Nicole Theodoraki, Ulm: Klinische Signifikanz der exosomalen PD-L1 Expression im Plasma von Kopf-Hals-Karzinom Patienten (HNSCC)

Kopf-Hals Karzinome sind bekanntlich hoch immunsuppressive Malignitäten. Trotz der breiten Auswahl an Therapieregiments, haben HNSCC Patienten weiterhin ein schlechtes Outcome, hauptsächlich aufgrund der frühen lymphatischen Metastasierung und lokoregionären Rezidiven. Das für HNSCC charakteristische immunsuppressive Profil entsteht unter anderem durch die Produktion von diversen inhibitorischen Faktoren im Tumormikromilieu. Eine hohe PD-L1 Expression in HNSCC geht mit einer schlechteren Prognose einher. Dennoch profitieren nicht alle Patienten von einer Immuntherapie.
Exosome aus Tumorzellen beinhalten diverse immunsuppressive Moleküle, die in konzentrierter Form an die Immunzellen weitergegeben werden. Wir haben gezeigt, dass Exosome von HNSCC Patienten eine signifikante Rolle in der Regulation der Tumorentwicklung spielen. Somit stellt sich die Frage ob die exosomale Expression von PD-1 und PD-L1 verantwortlich ist für die klinisch beobachteten immunologischen Effekte.
Exosome von 40 HNSCC Patienten wurden aus dem Plasma mittels „mini size exclusion“ Chromatographie extrahiert. Nach Bindung mit CD63 Antikörper-bead Komplexen wurde PD-1 und PD-L1 durchflusszytometrisch gemessen. PD-L1high oder PD-L1low Exosome wurden mit aktivierten CD8+ T-Zellen inkubiert mit/ohne PD-1 Inhibitor. Die T-Zell Aktivität wurde gemessen durch Bestimmung der CD69 Oberflächenexpression. Zusätzlich wurden Plasmaproben dieser Patienten auf frei lösliches PD-L1 getestet.
Als Erstes wurde der Proteingehalt der exosomalen Fraktion gemessen als Marker für die Exosom-Last. Hier war ersichtlich, dass Patienten mit einer aktiven Tumorerkrankung (active disease, AD) signifikant höhere Proteinkonzentrationen aufwiesen im Vergleich zu Patienten mit Zustand nach einer Tumorerkrankung (no evident disease, NED). Die exosomale PD-L1 Oberflächenexpression korrelierte mit der Tumoraktivität, sowie dem UICC Stadium der Patienten. Patienten mit einer Lymphknotenmetastasierung, einem hohem UICC Stadium und einer AD hatten signifikant höhere PD-L1 Levels auf den Exosomen (Abbildung 1). Die PD-1 Expression und das lösliche PD-L1 im Plasma zeigten keine signifikante Korrelation.
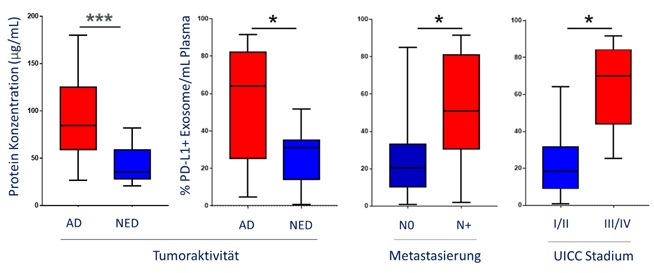
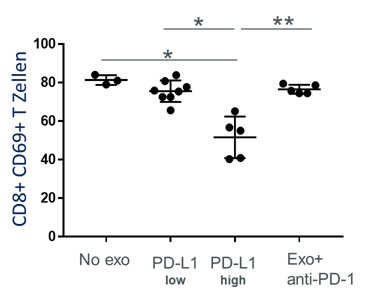
Um die funktionelle Relevanz von PD-L1 auf der Oberfläche von Exosomen zu testen, wurden aktivierte CD8+ T Zellen mit Exosomen inkubiert, die entweder einen hohen PD-L1 Oberflächengehalt hatten oder einen niedrigen. Die T-Zell Aktivität konnte signifikant durch PD-L1high Exosome inhibiert werden im Vergleich zu PD-L1low Exosome, die eine geringgradige Inhibition bewirkten. Die signifikante Suppression durch PD-L1high Exosome konnte jedoch nahezu vollständig aufgehoben werden durch den Zusatz eines PD-1 Inhibitors (Abbildung 2).
In dieser Arbeit konnte zum ersten Mal gezeigt werden, dass exosomale PD-L1 Levels -aber nicht die Plasma PD-L1 Levels- mit pathologischen Parametern in Kopf-Hals-Karzinom Patienten korrelieren. Die Inhibierung der PD-1/PD-L1 Achse konnte durch einen anti-PD-1 Antikörper effektiv revidiert werden. Somit wurde ersichtlich, dass Exosome aktiv den PD-1/PD-L1 Signalweg in T Zellen beeinflussen können. Demnach können Exosome nicht nur als Marker der Tumor- und Immunaktivität in HNSCC Patienten dienen sondern sollten bei Therapien mit Immun-Checkpoint-Inhibitoren berücksichtigt werden.
Prof. Dr. Christian Doehn, Urologikum Lübeck: Das metastasierte Nierenzellkarzinom: Was war 2018? Was kommt 2019?

Derzeit sind neben den Zytokinen Interferon-alpha und Interleukin-2 weitere 13 Medikamente zur Therapie des metastasierten Nierenzellkarzinoms zugelassen. Die meisten Vertreter gehören zu den Tyrosinkinase-Inhibitoren (TKI). Neue immunonkologische Ansätze beinhalten insbesondere antikörperbasierte Strategien. Von den wohl in mindestens dreistelliger Zahl vorliegenden Checkpoints auf der Oberfläche von Immun- und Tumorzellen (u.a.) spielen beim Nierenzellkarzinom die antikörper-vermittelte Checkpoint-Inhibitoren (CPI) von PD-1 (z.B. Nivolumab), PD-L1 (z.B. Atezolizumab) sowie CTLA-4 (z.B. Ipilimumab) derzeit die größte Rolle.
Verschiedene klinische und laborchemische Parameter erlauben eine Aussage zur Prognose des Patienten mit metastasiertem Nierenzellkarzinom. Dies gilt insbesondere im Hinblick auf das Gesamtüberleben (overall survival, OS), weniger für das progressionsfreie Überleben (progression-free survival, PFS) und gar nicht für das Ansprechen (response rate, RR). Im MSKCC-Score (auch Motzer-Score) werden die Parameter Allgemeinzustand, Zeit von Diagnose bis zur Therapie (von Metastasen), Hämoglobin, Laktatdehydrogenase und korrigiertes Kalzium betrachtet und für jedes abnorme Ergebnis ein Punkt verteilt. Eine gute, intermediäre und schlechte Prognose (im Hinblick auf das OS) wird angenommen bei 0 Punkten, 1-2 Punkten bzw. 3 und mehr Punkten. Im IMDC-Score (auch Heng-Score) werden die Parameter Allgemeinzustand, Zeit von Diagnose bis zur Therapie (von Metastasen), Hämoglobin, korrigiertes Kalzium, neutrophile Granulozyten und Thrombozyten betrachtet und für jedes abnorme Ergebnis ein Punkt verteilt. Eine gute, intermediäre und schlechte Prognose (im Hinblick auf das OS) wird angenommen bei 0 Punkten, 1-2 Punkten bzw. 3 und mehr Punkten. In den Studien der letzten Jahre wurden die o.g. Scores und auch die jeweiligen Risikogruppen in unterschiedlicher Weise verwendet. Teilweise sind diese Aspekte auch in den Zulassungstext übernommen worden. Das genannte Vorgehen erschwert den Vergleich verschiedener Studien.
Was war in 2018?
In der Erstlinientherapie des metastasierten Nierenzellkarzinoms haben sich seit Mitte 2017 drei Veränderungen ergeben. Der TKI Tivozanib wurde von der EMA zugelassen – basierend auf den Ergebnissen einer älteren Phase-III-Studie gegen Sorafenib. Für den TKI Cabozantinib, welcher bereits in der Zweitlinientherapie eingesetzt wird, wurde die Zulassung auf die Erstlinientherapie erweitert. Basis hierfür waren die Ergebnisse einer Phase-II-Studie gegen Sunitinib. Außerdem wurde die Kombination von Nivolumab und Ipilimumab zugelassen. Diese Kombination hat ihre Überlegenheit in einer Phase-III-Studie gegenüber Sunitinib für die Endpunkte PFS, die RR und das OS gezeigt – allerdings „nur“ für Patienten mit intermediärer oder schlechter Prognose nach den IMDC-Kriterien. Bei Patienten mit guter Prognose zeigte Sunitinib bessere Ergebnisse für die Parameter PFS und RR.
Was kommt in 2019?
In der Erstlinientherapie des metastasierten Nierenzellkarzinoms werden neben der bereits genannten Kombination Nivolumab/Ipilimumab auch andere Kombinationen geprüft. Es handelt sich hierbei um eine Kombination des CPI Atezolizumab und Bevacizumab (IMmotion 151) bzw. um eine Kombination des CPI Pembrolizumab mit Axitinib (Keynote-426) bzw. eine Kombination des CPI Avelumab mit Axitinib (Javelin Renal 101). In allen Studien wird gegen Sunitinib geprüft. Die besten Ergebnisse für die Endpunkte PFS, RR und OS liegen derzeit aus der Keynote-426 vor, wobei die Daten für den Endpunkt OS in keiner der genannten drei Studien „reif“ sind.
Bei aller Euphorie über die Ergebnisse der genannten Kombinationsstudien muss beachtet werden, dass die Anzahl Grad3/4-Nebenwirkungen höher ist als bei einer CPI-Monotherapie. Ebenso können sich neue therapeutische Herausforderungen im Nebenwirkungsmanagement ergeben. Als Beispiel sei genannt: TKI-bedingte Diarrhoe vs. CPI-bedingte Diarrhoe vs. Kombination aus beiden Ursachen.
Zukünftige Aktivitäten müssen weiterhin Antworten auf die folgenden Punkte liefern: Patientenselektion, Biomarker, (bildgebende) Bewertung des Therapieansprechens und Nebenwirkungsmanagement.








