Die DGFIT unterstützt seit ihrer Gründung wissenschaftliche Forschungsprojekte auf dem Gebiet der Immun- und Targeted Therapie. Unter anderem wird jährlich der normalerweise mit 2.000,00 Euro dotierte Clinical Science Award vergeben.
Ein unabhängiges Preiskomitee kam nach Begutachtung der ungewöhnlich vielen guten eingereichten Arbeiten zu dem Schluss, den diesjährigen „Clinical Science Award“ der DGFIT diesmal an einen 1. Platz und zwei 2. Plätze (insgesamt 4.000,00 Euro) zu vergeben.
Der 1. Platz ging an Dr. Marie-Nicole Theodoraki, Ulm, für die Arbeit
„Klinische Signifikanz der exosomalen PD-L1 Expression im Plasma von Kopf-Hals-Karzinom Patienten (HNSCC)“,
der 2. Platz an PD Dr. Philipp Wolf, Freiburg für die Arbeit
Targeted induction of the intrinsic apoptotic pathway in prostate cancer – a way out of a therapeutic dead end?
und an Dr. Johanes Breyer für die Arbeit
High PDL1 mRNA expression predicts better survival of stage pT1 non‑muscle‑invasive bladder cancer (NMIBC) patients

Zusammenfassung der Arbeiten:
Klinische Signifikanz der exosomalen PD-L1 Expression im Plasma von Kopf-Hals-Karzinom Patienten (HNSCC)
Kopf-Hals Karzinome sind bekanntlich hoch immunsuppressive Malignitäten. Trotz der breiten Auswahl an Therapieregiments, haben HNSCC Patienten weiterhin ein schlechtes Outcome, hauptsächlich aufgrund der frühen lymphatischen Metastasierung und lokoregionären Rezidiven. Das für HNSCC charakteristische immunsuppressive Profil entsteht unter anderem durch die Produktion von diversen inhibitorischen Faktoren im Tumormikromilieu. Eine hohe PD-L1 Expression in HNSCC geht mit einer schlechteren Prognose einher. Dennoch profitieren nicht alle Patienten von einer Immuntherapie.
Exosome aus Tumorzellen beinhalten diverse immunsuppressive Moleküle, die in konzentrierter Form an die Immunzellen weitergegeben werden. Wir haben gezeigt, dass Exosome von HNSCC Patienten eine signifikante Rolle in der Regulation der Tumorentwicklung spielen. Somit stellt sich die Frage ob die exosomale Expression von PD-1 und PD-L1 verantwortlich ist für die klinisch beobachteten immunologischen Effekte.
Exosome von 40 HNSCC Patienten wurden aus dem Plasma mittels „mini size exclusion“ Chromatographie extrahiert. Nach Bindung mit CD63 Antikörper-bead Komplexen wurde PD-1 und PD-L1 durchflusszytometrisch gemessen. PD-L1high oder PD-L1low Exosome wurden mit aktivierten CD8+ T-Zellen inkubiert mit/ohne PD-1 Inhibitor. Die T-Zell Aktivität wurde gemessen durch Bestimmung der CD69 Oberflächenexpression. Zusätzlich wurden Plasmaproben dieser Patienten auf frei lösliches PD-L1 getestet.
Als Erstes wurde der Proteingehalt der exosomalen Fraktion gemessen als Marker für die Exosom-Last. Hier war ersichtlich, dass Patienten mit einer aktiven Tumorerkrankung (active disease, AD) signifikant höhere Proteinkonzentrationen aufwiesen im Vergleich zu Patienten mit Zustand nach einer Tumorerkrankung (no evident disease, NED). Die exosomale PD-L1 Oberflächenexpression korrelierte mit der Tumoraktivität, sowie dem UICC Stadium der Patienten. Patienten mit einer Lymphknotenmetastasierung, einem hohem UICC Stadium und einer AD hatten signifikant höhere PD-L1 Levels auf den Exosomen (Abbildung 1). Die PD-1 Expression und das lösliche PD-L1 im Plasma zeigten keine signifikante Korrelation.
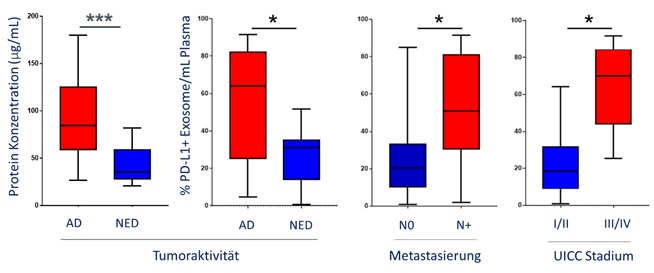
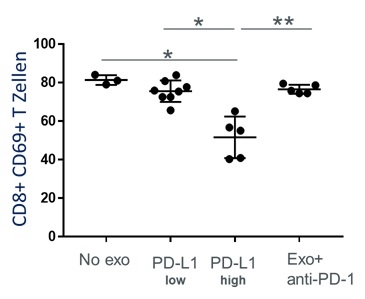
Um die funktionelle Relevanz von PD-L1 auf der Oberfläche von Exosomen zu testen, wurden aktivierte CD8+ T Zellen mit Exosomen inkubiert, die entweder einen hohen PD-L1 Oberflächengehalt hatten oder einen niedrigen. Die T-Zell Aktivität konnte signifikant durch PD-L1high Exosome inhibiert werden im Vergleich zu PD-L1low Exosome, die eine geringgradige Inhibition bewirkten. Die signifikante Suppression durch PD-L1high Exosome konnte jedoch nahezu vollständig aufgehoben werden durch den Zusatz eines PD-1 Inhibitors (Abbildung 2).
In dieser Arbeit konnte zum ersten Mal gezeigt werden, dass exosomale PD-L1 Levels -aber nicht die Plasma PD-L1 Levels- mit pathologischen Parametern in Kopf-Hals-Karzinom Patienten korrelieren. Die Inhibierung der PD-1/PD-L1 Achse konnte durch einen anti-PD-1 Antikörper effektiv revidiert werden. Somit wurde ersichtlich, dass Exosome aktiv den PD-1/PD-L1 Signalweg in T Zellen beeinflussen können. Demnach können Exosome nicht nur als Marker der Tumor- und Immunaktivität in HNSCC Patienten dienen sondern sollten bei Therapien mit Immun-Checkpoint-Inhibitoren berücksichtigt werden.
PD Dr. rer. nat. Philipp Wolf, Freiburg
Gezielte Aktivierung des intrinsischen Apoptosewegs beim fortgeschrittenen Prostatakarzinom – ein Ausweg aus der therapeutischen Sackgasse?
Für das fortgeschrittene Prostatakarzinom existiert bis heute keine kurative Therapie. Hintergrund sind genetische und epigenetische Änderungen, die in verschiedenen androgen-abhängigen und –unabhängigen Signalwegen während Tumorgenese, -progression und Therapie entstehen und die zu Resistenzen und letztlich zum Therapieversagen führen [1]. Wir haben für unseren neuen immuntherapeutischen Ansatz deshalb einen Signalweg ausgewählt, der auch in fortgeschrittenen Tumorstadien noch funktionell vorliegt: den intrinsischen Apoptoseweg.
Zentrale Elemente dieses Signalwegs sind Proteine der Bcl-2 (B cell lymphoma 2) Familie. Auf der einen Seite gibt es die pro-apoptotischen Proteine, zu denen die Sensibilisatoren (BAD, NOXA) und die Effektoren (Bax, Bak) gehören. Auf der anderen Seite gibt es die anti-apoptotischen Proteine, deren wichtigste Vertreter Bcl-2, Bcl-xl und Mcl-1 sind. In einer lebenden Zelle liegen die Effektoren Bax und Bak gebunden an die anti-apoptotischen Proteine Bcl-2, Bcl-xl und Mcl-1 vor und sind dadurch blockiert. Kommt es zu einem Apoptose-Stimulus in der Zelle, fangen die Sensibilisatoren BAD und NOXA die anti-apoptotischen Proteine ab. Dadurch werden die Effektoren Bax und Bak freigesetzt und können in den Mitochondrienmembranen der Zelle Poren bilden. Dies führt zu einer Freisetzung von Cytochrom C aus den Mitochondrien, zur Aktivierung proteolytischer Caspasen und damit zum Zelltod (Abb. 1A).
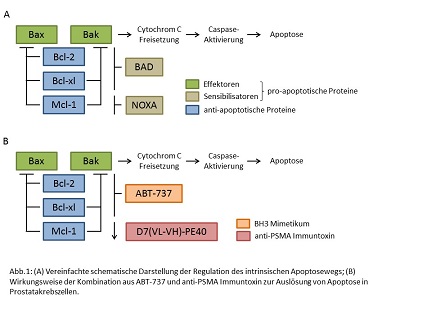
Wie bei anderen Tumoren auch, kann beim fortgeschrittenen Prostatakarzinom eine erhöhte Expression der anti-apoptotischen Proteine Bcl-2, Bcl-xl und Mcl-1 beobachtet werden, die zur Apoptoseresistenz führt. Interessanterweise liegen aber auch die pro-apoptotischen Effektoren Bax und Bak in 77,5-100% aller Karzinome unabhängig vom Tumorgrad vor; zudem stellen Mutationen in Bax und Bak nur sehr seltene Ereignisse dar [2,3]. Dies bedeutet, dass die Effektoren Bax und Bak in allen Stadien des Prostatakarzinoms funktionell vorhanden sind und zu einer direkten Auslösung von Apoptose in den Tumorzellen führen können. Wir identifizierten deshalb die anti-apoptotischen Proteine Bcl-2, Bcl-xl und Mcl-1 als Zielstrukturen unserer Therapie, damit Bax und Bak zur Auslösung von Apoptose freigesetzt werden können.
Mit dem BH3 Mimetikum ABT-737 und seinem oral verabreichbaren Analogon ABT-263 (Navitoclax) existieren Inhibitoren, die strukturell dem Sensibilisator BAD gleichen und entsprechend diesem Bcl-2 und Bcl-xl binden können. Sie können damit zur Freisetzung von Bak und Bax und damit zur Auslösung von Apoptose in Zielzellen führen. Da sie jedoch Mcl-1 nicht hemmen, ist ihre anti-tumoröse Wirkung gerade in Tumoren, die wie das Prostatakarzinom eine Mcl-1 Hochregulierung aufweisen, sehr begrenzt [4].
Wir kombinierten deshalb ABT-737 mit dem Immuntoxin D7(VL-VH)-PE40, welches in unserem Labor entwickelt wurde [5]. Das Immuntoxin besteht aus dem Antikörperfragment D7(VL-VH), welches an das Prostataspezifische Membranantigen (PSMA) auf Prostatakrebszellen bindet. Die Toxindomäne PE40 stammt aus dem Virulenzfaktor Exotoxin A des Bakteriums Pseudomonas aeruginosa und führt zur Inhibition der Proteinbiosynthese in Zielzellen [6].
Wir konnten zeigen, dass unser Immuntoxin zu einer schnellen Herunterregulierung von Mcl-1 führte. Die Kombination von ABT-737 mit dem Immuntoxin führte zur Auslösung von Apoptose in PSMA-positiven Prostatakrebszellen und synergistischen zytotoxischen Effekten mit mittleren, effektiven Konzentration im niedrigen picomolaren Bereich [7].
Mechanistisch betrachtet konnten Bcl-2 und Bcl-xl durch ABT-737 gehemmt und Mcl-1 durch das Immuntoxin herunterreguliert werden. Dies führte zur Freisetzung von Bax und Bak und zur gezielten Auslösung von Apoptose (Abb. 1B). Zurzeit wird die antitumoröse Wirkung dieser Kombinationstherapie in vivo überprüft.
Die Kombination aus ABT-737 und Immuntoxin könnte künftig eine Alternative für Patienten mit fortgeschrittenem Prostatakarzinom darstellen, bei denen es zum Versagen etablierter Therapien gekommen ist. Sie könnte, unabhängig von Änderungen in androgen-abhängigen und -unabhängigen Signalwegen, zur gezielten und direkten Auslösung von Apoptose in Prostatakrebszellen eingesetzt werden.
Das Projekt wird von der Wilhelm Sander-Stiftung unterstützt (Nr. 2016.089.1).
1. Katzenwadel A and Wolf P: Cancer Lett 2015; 367(1): 12-17.
2. Krajewska M et al.: Am J Pathol 1998; 148: 1567-76.
3. Anvari K et al.: Urol J 2012; 9: 381-388.
4. Wolf P: Front Pharmacol 2017; 8: 557.
5. Michalska M et al.: Oncotarget 2016; 7(16): 22531-22542.
6. Michalska M and Wolf P: Front Microbiol 2015; 6: 963.
7. Noll T et al.: Cancer Immunol Immunother 2018; 67(3), 413-422.








