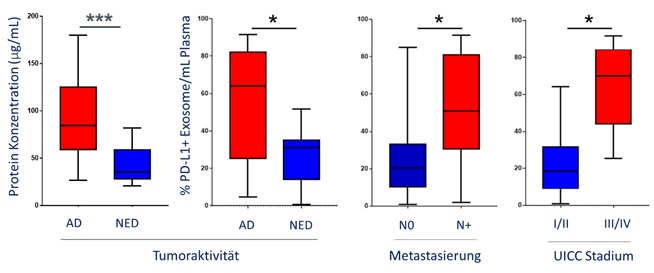
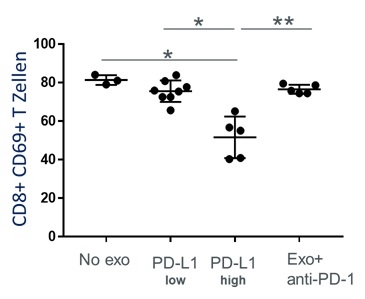
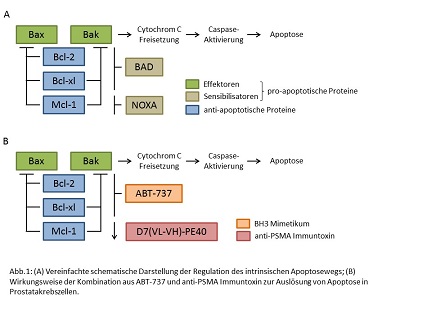
Die DGFIT unterstützt seit ihrer Gründung wissenschaftliche Forschungsprojekte auf dem Gebiet der Immun- und Targeted Therapie. Unter anderem wird jährlich der mit 2.000,00 Euro dotierte Clinical Science Award vergeben. Ein unabhängiges Preiskomitee kam nach Begutachtung der eingereichten Arbeiten dieses Jahr zu dem Schluss, für den „Clinical Science Award 2023“ einen ersten und einen zweiten Platz zu vergeben, dotiert mit 2.000,00 Euro bzw. 1.000,00 Euro
1. Preis:
Mit dem 1. Preis des CSA 2023 wurde Dr. Sophia Stock (München) ausgezeichnet für ihre Arbeit „Chimeric antigen receptor T cells engineered to recognize the P329G-mutated Fc part of effector-silenced tumor antigen-targeting human IgG1 antibodies enable modular targeting of solid tumors“.

Zusammenfassung
Die Therapie mit chimären Antigenrezeptor (CAR)-modifizierten T-Zellen hat die therapeutischen Möglichkeiten von Patienten mit hämatologischen Erkrankungen maßgeblich verändert. Allerdings kann es auch hier zu Therapieversagen und Rückfällen kommen. Bei soliden Tumoren muss die Wirksamkeit der CAR-T-Zelltherapie überhaupt erst belegt werden. Gerade in soliden Tumoren, begrenzen behandlungsassoziierte Toxizitäten und die Antigenheterogenität der malignen Zellen den therapeutischen Erfolg der CAR-T-Zelltherapie. Um diesen vielversprechenden Behandlungsansatz weiter zu verbessern, können modulare CAR-T-Zell-Plattformen den entscheidenden Beitrag leisten. Klassische CAR-T-Zellen erkennen nur ein Tumorantigen und können somit nur Tumorzellen angreifen, die dieses spezifische Antigen tragen. Modulare CAR-T-Zellen wiederum binden ein CAR-Adaptormolekül, welches dann das Tumorantigen bindet. CAR-Adaptormoleküle sind typischerweise humane Immunglobulin G Antikörper, die mit einem spezifischen „tag“ (engl.: Kennzeichen) markiert sind, welches von dem CAR erkannt wird. Nachteil von diesem Konzept ist die Notwendigkeit der Entwicklung sowohl des CAR-Adaptormoleküles als auch des CAR-T-Zellproduktes.
Bei der P329G-Mutation handelt es sich um eine etablierte Fc-Mutation, die eine Interaktion des Antikörpers mit Fc Rezeptoren oder dem Komplementsystem verhindert und die bereits klinisch in diversen Antikörpern angewendet wird. Durch Verwendung bereits entwickelter und klinisch etablierter P329G-mutierter Antikörper als CAR-Adaptormoleküle bedarf es keiner zusätzlichen Einführung von artifiziellen „tags“ oder posttranslationale Modifikationen. Wir haben ein neuartiges und modulares CAR-Konstrukt entwickelt, das auf diese P329G-Mutation abzielt. Dies ermöglicht die Kombination von gegen P329G gerichteten CAR-T-Zellen mit bereits entwickelten effektorsilenten Antikörpern, die die P329G-Mutation in ihrem Fc-Teil tragen. Im Falle einer schweren CAR-assoziierten Nebenwirkung oder eines Antigen-negativen Rückfalles kann die Dosis des CAR-Adaptormoleküles angepasst oder das Adaptormolekül komplett ausgetauscht werden.
Wir konnten spezifische in vitro und in vivo Effektorfunktionen der anti-P329G CAR-T-Zellen in Mesotheliom-, Bauchspeicheldrüsen- und Brustkrebsmodellen zeigen. Zudem konnten wir die Modularität und Reversibilität dieser neuartigen CAR-T-Zell-Plattform in vitro und in vivo nachweisen. Dies bildet die Grundlage für die weitere Umsetzung dieser modularen CAR-T-Zellplattform für die Behandlung von Krebspatienten.
2. Preis:
Den 2. Preis erhielt Prof. Dr. Michael Koldehoff (Essen) für seine Arbeit „Long-Term Follow-Up after Adoptive Transfer of BK-Virus-Specific T Cells in Hematopoietic Stem Cell Transplant Recipients”

Zusammenfassung
Die allogene hämatopoetische Stammzelltransplantation (alloSZT) gehört seit Anfang der siebziger Jahre zu einem Standardverfahren der Behandlung hämatologischer Neoplasien. Innerhalb der letzten Jahre ist eine kontinuierliche Ausweitung der Indikation dieser Therapieform zu verzeichnen. Auch konnten erhebliche Fortschritte in der Verfügbarkeit und Identifizierung passender Spender durch den Aufbau von Fremdspenderdateien und Nabelschnurbanken und den Einsatz haploidenter-Spender erzielt werden.
Dabei ist die alloSZT eine hoch komplexe, für die Patienten*innen1 sehr intensive Therapie, die zwar für viele, insbesondere hämatologische Erkrankungen ein hohes kuratives Potential besitzt, jedoch auf Grund der Komplexität auch ein hohes Risiko therapiebedingter Morbidität und auch Mortalität besitzt. Infektionen stellen eine wesentliche Komplikation in der Behandlung von Patienten mit hämatologischen Erkrankungen bzw. im Rahmen einer alloSZT dar. Das Risiko und der Schweregrad von Infektionen werden durch das Stadium der Grunderkrankung, die Vorbehandlung, die Transplantationsmodalität (z. B. Grad der HLA-Übereinstimmung zwischen Spender und Empfänger, Immunsuppression), die Rekonstitution der Hämatopoese und immunologische Reaktionen (z.B. Transplantat-gegen-Wirt-Erkrankung (GvHD) bestimmt. Unbefriedigend gelöste Probleme betreffen die Vermeidung und adäquate Behandlung von typischen Infektionsmustern mit hoher Frühtoxizität, vorwiegend in der therapieinduzierten Neutropenie bzw. der zellulären Immunsuppression durch antineoplastische Medikamente, Steroide und Antithymozytenglobuline sowie der Gabe von antiinfektiösen Agenzien dar. Abgesehen von den Viren der Herpesgruppe (Herpes-simplex-Virus, Varicella-Zoster-Virus, humanes Herpesvirus Typ 6 und 8, Epstein-Barr-Virus, Cytomegalievirus), die neben den bekannten klinischen Manifestationen, wie der Gürtelrose, auch generalisierte Krankheitsbilder in Form von Septikämien, Pneumonien und Enzephalitiden hervorrufen können, spielen auch andere Viren eine pathogene Rolle (z. B. Parvovirus B19, Papillomaviren, Adenoviren). Das BK Virus (BKV), ein DNA-Virus, das auch als Betapolyomavirus hominis bezeichnet wird, ist eine Ursache für schwere hämorrhagische Zystitiden und Nephropathien bei Patienten, die mit einer alloSZT behandelt wurden. BKV wurde erstmals 1971 aus dem Urin eines Nierentransplantat-Empfängers isoliert und trägt die Initialen B.K. dieser Person. Das Virus kann über Schmierinfektionen mit Urin, Tröpfcheninfektion oder kontaminiertes Trinkwasser übertragen werden, und in der erwachsenen Bevölkerung liegt die Ansteckungsrate mit BKV bei mehr als 80 %. Bei alloSZT-Patienten konnte neben dem Uroepithel auch der Gastrointestinaltrakt als wichtiger Persistenzort identifiziert werden. Das BKV bleibt nach der Primärinfektion persistent und kann während der Immunsuppression reaktiviert werden. Bei immunkompetenten Personen verläuft die BKV-Infektion jedoch in der Regel asymptomatisch. Bei immungeschwächten Personen nimmt die BKV-Replikation Geschwindigkeit und Ausmaß der BKV-Replikation zu und führt zur hämorrhagischen Zystitis und Nephropathie bei 5-50 % der Empfänger einer alloSZT. Die Inzidenz der BKV-bedingten hämorrhagischen Zystitis nach alloSZT variiert stark zwischen erwachsenen (bis zu 50 %) und pädiatrischen Empfängern (bis zu 25 %) sowie insbesondere unterschiedlich im Zusammenhang mit einer GvHD.
In der aktuellen Arbeit konnten wir herausfinden, dass um reaktivierte BKV bei symptomatischen Patienten nach alloSZT zu eliminieren, mehrere therapeutische Ansätze für die Behandlung der BKV-bedingten hämorrhagischen Zystitis verfolgt werden. Die Verringerung oder Beendigung der Immunsuppression um die Anti-BKV-Immunität zu verstärken, wurde in einigen wenigen Fällen untersucht, wobei ein günstiges Risiko-Nutzen-Verhältnis bei dieser Maßnahme gegen das Risiko einer Alloreaktivität mit Entwicklung einer GvHD zu berücksichtigen ist. Alternativ könnten die Patienten mit dem antiviralen Medikament Cidofovir behandelt werden, einem Cytosinderivat eines azyklischen Nukleosid-Phosphonat-Analogons, das ein breites Wirkungsspektrum gegen viele DNA-Viren einschließlich BKV aufweist. Zu beachten ist jedoch, dass BKV nicht über eine DNA-Polymerase verfügt. Die Behandlung mit Cidofovir kann ferner zu einer Nephrotoxizität und Neutropenie führen. Schließlich spielen virusspezifische T-Zellen (VSTs) eine Schlüsselrolle bei der Eliminierung einer reaktivierten BKV-Infektion als eine vielversprechende Behandlungsoption. Die Generierung und klinische Wirkung von BKV-spezifischen VSTs im Rahmen der alloSZT wurde von mehreren Gruppen beschrieben, jedoch sind Daten zur Überwachung BKV-spezifischer T-Zellen bei alloSZT-Empfängern weiterhin spärlich. Die meisten Studien berichteten über ausgezeichnete klinische Effektivitäten mit einem Rückgang der Viruslast und einer Verbesserung der Symptomatik bei 74-100 % der Patienten. Wir verglichen die Wirkung von VSTs mit anderen Behandlungsoptionen und verfolgten die spezifischen T-Zellen mit einem Interferon-gamma-ELISpot-Assay. Im Vergleich zu früheren Studien über zelluläre Reaktionen bei alloSZT-Empfängern nach Infusion von BKV-spezifischen VSTs war die Nachbeobachtungszeit länger (bis zu 910 Tage, d.h. 30 Monate, nach VSTs) und wir zeigen parallel die Zeitverläufe der BKV-spezifischen T-Zellimmunität, die Viruslast und der immunsuppressiven Medikation. Bei 12 von 17 alloSZT-Empfängern mit BKV-bedingter Blasenentzündung (71 %) konnten wir große Unterschiede der BKV-spezifische zelluläre Reaktionen beobachten. Bei den beiden Patienten, bei denen nur die Immunsuppression reduziert wurde, konnten wir einen Rückgang der Viruslast im Serum und/oder Urin feststellen und BKV-spezifische T-Zellen messen. Alle acht Patienten, die nur mit Cidofovir behandelt wurden, zeigten einen Rückgang der Viruslast. Die Hälfte von ihnen zeigten spezifische T-Zell-Reaktionen. Bei den beiden Patienten, die nur mit VSTs behandelt wurden, beobachteten wir eine Verringerung der Viruslast und konnten eine spezifische T-Zell-Immunität nachweisen. Fünf Patienten wurden mit Cidofovir und VSTs behandelt. Drei von ihnen zeigten eine Verringerung der Viruslast und vier zeigten eine BKV-spezifische T-Zell-Antwort. Bei den mit VST behandelten Empfängern zeigten 6 von 7 eine spezifische T-Zell-Antwort, bei denen ohne VST waren es 6 von 10. Im Vergleich dazu reagierten 27 von 50 gesunden Kontrollpersonen (54 %). Bei alloSZT-Empfängern, die wegen BKV-bedingter Blasenentzündung behandelt wurden, korrelierten die absolute Zahl der CD4+ T-Zellen und die Nierenfunktion mit den BKV-spezifischen zellulären Reaktionen (p = 0,03 bzw. 0,01). Bei einem Patienten konnte die BKV-spezifische zelluläre Immunität bereits zu Beginn, am Tag 35 nach der alloSZT und vor den VSTs nachgewiesen werden und blieb bis zum Tag 226 nach den VSTs erhöht (78 vs. 7 Punkte, Zuwachs). Zusammenfassend lässt sich sagen, dass der ELISpot geeignet zu sein scheint, die BKV-spezifische zelluläre Immunität bei alloSZT-Empfängern empfindlich zu überwachen, und zwar sowohl früh nach der Transplantation als auch langfristig nach VSTs.
1 Aus Gründen der besseren Lesbarkeit wird das generische Maskulinum verwendet. Weibliche und anderweitige Geschlechteridentitäten werden dabei ausdrücklich mitgemeint.